صيغة لحل مشاكل الحلول المخففة. حسابات تحضير المحاليل المائية
لتحضير محاليل التركيزات المولية والعادية ، يتم وزن عينة من المادة على ميزان تحليلي ، ويتم تحضير المحاليل في دورق حجمي. عند تحضير المحاليل الحمضية ، يتم قياس الحجم المطلوب من محلول حامض مركّز باستخدام سحاح بحنفية زجاجية.
يُحسب وزن المذاب إلى المكان العشري الرابع ، ويتم أخذ الأوزان الجزيئية بدقة معطاة في الجداول المرجعية. يتم حساب حجم الحمض المركز حتى المكان العشري الثاني.
مثال 1. ما عدد جرامات كلوريد الباريوم اللازمة لتحضير 2 لتر من محلول 0.2 مولار؟
حل.الوزن الجزيئي لكلوريد الباريوم هو 208.27. لذلك. يجب أن يحتوي 1 لتر من محلول 0.2 م على 208.27-0.2 = = 41.654 جم BaCl 2. لتحضير 2 لتر ، ستحتاج إلى 41.654-2 \ u003d 83.308 جم من BaCl 2.
مثال 2. كم جرام من الصودا اللامائية Na 2 C0 3 ستكون مطلوبة لتحضير 500 مل من 0.1 ن. حل؟
حل.الوزن الجزيئي للصودا هو 106.004 ؛ وزن المشاركة المكافئ 5 N a 2 C0 3 \ u003d M: 2 \ u003d 53.002 ؛ 0.1 مكافئ. = 5.3002 جم.
1000 مل 0.1 ن. يحتوي المحلول على 5.3002 جم من Na 2 C0 3
500 »» »» » X
»Na 2 C0 3
5,3002-500
س = —— Gooo-- = 2-6501 جم Na 2 C0 3.
مثال 3 ما هي كمية حامض الكبريتيك المركز (96٪: d = 1.84) المطلوبة لتحضير 2 لتر من 0.05N. محلول حامض الكبريتيك؟
حل.الوزن الجزيئي لحمض الكبريتيك هو 98.08. الكتلة المكافئة لحمض الكبريتيك 3 س 2 لذا 4 \ u003d M: 2 \ u003d 98.08: 2 \ u003d 49.04 جم الوزن 0.05 مكافئ. = 49.04-0.05 = 2.452 جم.
لنجد مقدار H 2 S0 4 الذي يجب احتوائه في 2 لتر 0.05 ن. حل:
1 لتر -2.452 جم H 2 S0 4
2 "- X »H 2 S0 4
X = 2.452-2 = 4.904 جم H 2 S0 4.
من أجل تحديد مقدار محلول 96٪ من H 2 S0 4 يجب أن يؤخذ لهذا الغرض ، نقوم بتكوين النسبة:
\ في 100 جرام تركيز. H 2 S0 4-96 جم H 2 S04
في»» H 2 S0 4 -4.904 جم H 2 S0 4
4,904-100
في= ——— §6—— = 5.11 جم H 2 S0 4.
قم بتحويل هذا المبلغ إلى الحجم: و. ر 5,11
K \ u003d 7 \ u003d TJ \ u003d 2 "77 مل -
وهكذا ، لتحضير 2 لتر من 0.05 ن. يجب أن يأخذ المحلول 2.77 مل من حامض الكبريتيك المركز.
مثال 4. احسب عيار محلول هيدروكسيد الصوديوم إذا كان تركيزه الدقيق معروفًا بأنه 0.0520 نيوتن.
حل.تذكر أن العيار هو محتوى 1 مل من محلول مادة بالجرام. الكتلة المكافئة من هيدروكسيد الصوديوم = 40 01 جم أوجد عدد جرامات هيدروكسيد الصوديوم الموجودة في لتر واحد من هذا المحلول:
40.01 - 0.0520 = 2.0805 جرام
1 لتر من المحلول: -u = - = 0.00208 جم / مل. يمكنك أيضًا استخدام الصيغة:
9 شمال
أين تي- عيار ، جم / مل ؛ ه- الوزن يعادل؛ ن-الحالة الطبيعية للحل.
ثم عيار هذا الحل هو:
F 40,01 0,0520
“هيدروكسيد الصوديوم = ——— جوو—— 0.00208 جم / مل.
"" Rie P 5 - احسب التركيز الطبيعي لمحلول HN0 3 ، إذا كان معروفًا أن عيار هذا الحل هو 0.0065. للحساب ، نستخدم الصيغة:
T ■ 1000 63,05
5hno 3 = j- = 63.05.
التركيز الطبيعي لمحلول حمض النيتريك هو:
- V = 63.05 = 0.1030 ن.
مثال 6. ما هو التركيز الطبيعي للمحلول إذا كان معروفًا أن 200 مل من هذا المحلول يحتوي على 2.6501 جم من Na 2 C0 3
حل.
كما تم حسابه في المثال 2 ، Zma 2 co (= 53.002.
لنجد عدد المكافئات 2.6501 جم من Na 2 C0 3: G
2.6501: 53.002 = 0.05 مكافئ. /
من أجل حساب التركيز الطبيعي للمحلول ، نقوم بتكوين النسبة:
1000 »» X "
1000-0,05
س =
—————— = 0.25 مكافئ.
سيحتوي 1 لتر من هذا المحلول على 0.25 مكافئ ، أي سيكون المحلول 0.25 ن.
لإجراء هذا الحساب ، يمكنك استخدام الصيغة:
ص- 1000
أين ر - كمية المادة بالجرام ؛ ه - الكتلة المعادلة للمادة ؛ الخامس هو حجم المحلول بالميليلتر.
Zia 2 co 3 \ u003d 53.002 ، ثم التركيز الطبيعي لهذا المحلول
2.6501-10С0 N = 53.002-200
حلول تقريبية.عند إعداد الحلول التقريبية ، يتم حساب كميات المواد التي يجب أخذها لهذا الغرض بدقة قليلة. يمكن تقريب الأوزان الذرية للعناصر لتبسيط العمليات الحسابية في بعض الأحيان إلى وحدات كاملة. لذلك ، لحساب تقريبي ، يمكن أخذ الوزن الذري للحديد يساوي 56 بدلاً من -55.847 بالضبط ؛ للكبريت - 32 بدلاً من 32.064 بالضبط ، إلخ.
يتم وزن المواد المستخدمة في تحضير الحلول التقريبية على المقاييس التقنية أو التقنية.
في الأساس ، الحسابات في إعداد الحلول هي نفسها تمامًا لجميع المواد.
يتم التعبير عن كمية المحلول المحضر إما بوحدات الكتلة (g ، kg) أو بوحدات الحجم (ml ، l) ، ولكل من هذه الحالات ، يتم حساب كمية المادة المذابة بشكل مختلف.
مثال. يجب تحضير 1.5 كجم من محلول كلوريد الصوديوم بنسبة 15٪ ؛ احسب مسبقًا الكمية المطلوبة من الملح. يتم الحساب حسب النسبة:
أي إذا احتوى 100 جم من المحلول على 15 جم من الملح (15٪) ، فما المقدار المطلوب لتحضير 1500 جم من المحلول؟
يوضح الحساب أنك بحاجة إلى أن تزن 225 جم من الملح ، ثم خذ 1500-225 = 1275 جم. ¦
إذا تم إعطاؤه للحصول على 1.5 لتر من نفس المحلول ، ففي هذه الحالة ، وفقًا للكتاب المرجعي ، يتم اكتشاف كثافته ، ويتم ضرب الأخير بالحجم المحدد وبالتالي يتم العثور على كتلة الكمية المطلوبة من المحلول . وبالتالي ، فإن كثافة محلول أورو بنسبة 15٪ من كلوريد الصوديوم عند 15 درجة مئوية هي 1.184 جم / سم 3. لذلك ، 1500 مل

لذلك ، تختلف كمية المادة لتحضير 1.5 كجم و 1.5 لتر من المحلول.
الحساب المذكور أعلاه قابل للتطبيق فقط لإعداد محاليل المواد اللامائية. إذا تم أخذ ملح مائي ، على سبيل المثال Na2SO4-IOH2O1 ، فسيتم تعديل الحساب إلى حد ما ، حيث يجب أيضًا أخذ ماء التبلور في الاعتبار.
مثال. يجب أن يكون من الضروري تحضير 2 كجم من 10٪ محلول Na2SO4 بدءًا من Na2SO4 * 10H2O.
الوزن الجزيئي لـ Na2SO4 هو 142.041 و Na2SO4 * 10H2O هو 322.195 ، أو مقربًا 322.20.
يتم الحساب أولاً على الملح اللامائي:
لذلك ، تحتاج إلى تناول 200 غرام من الملح اللامائي. تم العثور على كمية ملح ديكاهيدراتي من الحساب:
يجب أخذ الماء في هذه الحالة: 2000 - 453.7 = 1546.3 جم.
نظرًا لأن المحلول لا يتم تحضيره دائمًا من حيث الملح اللامائي ، ثم على الملصق ، الذي يجب أن يكون عالقًا على الوعاء مع المحلول ، من الضروري الإشارة إلى الملح الذي يتم تحضير المحلول منه ، على سبيل المثال ، محلول 10 ٪ Na2SO4 أو 25٪ Na2SO4 * 10H2O.
غالبًا ما يحدث أن المحلول المُعد مسبقًا يحتاج إلى التخفيف ، أي يجب تقليل تركيزه ؛ يتم تخفيف المحاليل إما بالحجم أو بالوزن.
مثال. من الضروري تخفيف محلول 20٪ من كبريتات الأمونيوم للحصول على 2 لتر من محلول 5٪. نقوم بالحساب بالطريقة التالية. نتعلم من الكتاب المرجعي أن كثافة محلول 5٪ من (NH4) 2SO4 هي 1.0287 جم / سم 3. لذلك يجب أن تزن 2 لتر منها 1.0287 * 2000 = 2057.4 جم ويجب أن تحتوي هذه الكمية على كبريتات الأمونيوم:

بالنظر إلى احتمال حدوث خسائر أثناء القياس ، يجب أن تأخذ 462 مل وتصل إلى 2 لتر ، أي إضافة 2000-462 = 1538 مل من الماء إليها.
إذا تم إجراء التخفيف بالوزن ، يتم تبسيط الحساب. لكن بشكل عام ، يتم التخفيف على أساس الحجم ، لأن السوائل ، وخاصة في كميات كبيرةآه ، من الأسهل قياس الحجم بدلاً من الوزن.
يجب أن نتذكر أنه في جميع الأعمال ، مع كل من الذوبان والتخفيف ، لا ينبغي للمرء أبدًا صب كل الماء في الوعاء مرة واحدة. اشطف بالماء عدة مرات الأطباق التي تم فيها وزن أو قياس المادة المرغوبة ، وفي كل مرة يضاف هذا الماء إلى وعاء المحلول.
عندما لا تكون الدقة الخاصة مطلوبة ، عند تخفيف المحاليل أو خلطها للحصول على حلول بتركيز مختلف ، يمكنك استخدام الطريقة البسيطة والسريعة التالية.
دعونا نأخذ الحالة التي تم تحليلها بالفعل المتمثلة في تخفيف محلول 20٪ من كبريتات الأمونيوم إلى 5٪. أولا نكتب مثل هذا:

حيث 20 هو تركيز المحلول المأخوذ ، 0 هو الماء و 5 "هو التركيز المطلوب. الآن نطرح 5 من 20 ونكتب القيمة الناتجة في الزاوية اليمنى السفلية ، بطرح صفر من 5 ، نكتب الرقم في الجزء العلوي الزاوية اليمنى. ثم ستبدو الدائرة هكذا:

هذا يعني أنك بحاجة إلى تناول 5 أحجام من محلول 20٪ و 15 حجمًا من الماء. بالطبع ، مثل هذا الحساب ليس دقيقًا.
إذا قمت بخلط حلين من نفس المادة ، فسيظل المخطط كما هو ، ويتم تغيير القيم العددية فقط. دع محلول 25٪ يتم تحضيره بخلط محلول 35٪ و 15٪ محلول. ثم سيبدو الشكل كما يلي:

أي يجب أن تأخذ 10 مجلدات من كلا الحلين. يعطي هذا المخطط نتائج تقريبية ويمكن استخدامه فقط عندما لا تكون الدقة الخاصة مطلوبة. ومن المهم جدًا لأي كيميائي أن ينمي عادة الدقة في الحسابات عند الضرورة ، وأن يستخدم الأرقام التقريبية في الحالات التي لا يؤثر فيها ذلك على النتائج. العمل. عند الحاجة إلى دقة أكبر عند تخفيف المحاليل ، يتم الحساب باستخدام الصيغ.
لنلقِ نظرة على بعض أهم الحالات.
تحضير محلول مخفف. لنفترض أن c تكون مقدار المحلول ، m٪ هو تركيز المحلول المراد تخفيفه إلى تركيز n٪. يتم حساب المقدار الناتج من المحلول المخفف x بالصيغة:

ويحسب حجم الماء v لتخفيف المحلول بالصيغة:

خلط محلولين من نفس المادة بتركيز مختلف للحصول على محلول بتركيز معين.دع عن طريق خلط أجزاء من محلول m٪ مع x أجزاء من محلول n٪ ، تحتاج إلى الحصول على محلول /٪ ، ثم:

حلول دقيقة.عند إعداد الحلول الدقيقة ، سيتم التحقق بالفعل من حساب كميات المواد المطلوبة بدرجة كافية من الدقة. تؤخذ الأوزان الذرية للعناصر من الجدول الذي يوضح قيمها بالضبط. عند الجمع (أو الطرح) ، يتم استخدام القيمة الدقيقة للمصطلح الذي يحتوي على أقل عدد من المنازل العشرية. يتم تقريب الحدود المتبقية ، مما يترك منزلة عشرية واحدة بعد الفاصلة العشرية مقارنة بالمصطلح الذي يحتوي على أقل عدد من الأرقام. نتيجة لذلك ، يتم ترك العديد من الأرقام بعد الفاصلة العشرية كما هو الحال في المصطلح الذي يحتوي على أقل عدد من المنازل العشرية ؛ أثناء القيام بالتقريب اللازم. يتم إجراء جميع الحسابات باستخدام اللوغاريتمات ، خمسة أو أربعة أرقام. يتم وزن الكميات المحسوبة للمادة فقط على ميزان تحليلي.
يتم قياس الوزن إما على زجاج الساعة أو في زجاجة. تُسكب المادة التي تم وزنها في دورق حجمي مغسول بشكل نظيف من خلال قمع نظيف وجاف في أجزاء صغيرة. بعد ذلك ، من الغسالة ، عدة مرات مع أجزاء صغيرة من الماء ، يتم غسل bnzhe أو زجاج الساعة الذي تم فيه قياس الوزن فوق القمع. يتم أيضًا غسل القمع عدة مرات بالماء المقطر.
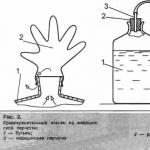
من أجل صب البلورات أو المساحيق الصلبة في دورق حجمي ، من الملائم جدًا استخدام القمع الموضح في الشكل. 349. تصنع هذه الأقماع بسعة 3 و 6 و 10 سم 3. يمكنك وزن العينة مباشرة في هذه الأقماع (المواد غير المسترطبة) ، بعد تحديد كتلتها مسبقًا. يتم نقل العينة من القمع بسهولة إلى الدورق الحجمي. عند سكب العينة ، يتم غسل القمع جيدًا بالماء المقطر من زجاجة الغسيل دون إزالة القارورة من الحلق.
كقاعدة عامة ، عند تحضير محاليل دقيقة ونقل المذاب إلى دورق حجمي ، يجب ألا يشغل المذيب (على سبيل المثال ، الماء) أكثر من نصف سعة القارورة. قم بسد الدورق الحجمي ورجه حتى تذوب المادة الصلبة تمامًا. ثم يتم ملء المحلول الناتج حتى العلامة بالماء ويخلط جيدًا.
حلول الضرس.لتحضير لتر واحد من محلول 1 م من مادة ما ، يتم وزن 1 مول منه على ميزان تحليلي ويتم إذابته كما هو موضح أعلاه.
مثال. لتحضير 1 لتر من محلول 1 M من نترات الفضة ، ابحث في الجدول أو احسب الوزن الجزيئي لـ AgNO3 ، فهو يساوي 169.875. يوزن الملح ويذوب في الماء.
إذا كنت بحاجة إلى تحضير محلول أكثر تمييعًا (0.1 أو 0.01 م) ، فقم بوزن 0.1 أو 0.01 مول من الملح على التوالي.
إذا كنت بحاجة إلى تحضير أقل من لتر واحد من المحلول ، فقم بإذابة كمية أقل مماثلة من الملح في الحجم المقابل من الماء.
يتم تحضير المحاليل العادية بطريقة مماثلة ، لا تزن فقط 1 مول ، ولكن 1 جرام مكافئ من مادة صلبة.
إذا كنت بحاجة إلى تحضير محلول شبه طبيعي أو غير طبيعي ، فاخذ 0.5 أو 0.1 جرام مكافئ ، على التوالي. عند تحضير ليس 1 لتر من المحلول ، ولكن أقل ، على سبيل المثال 100 أو 250 مل ، خذ 1/10 أو 1/4 من كمية المادة المطلوبة لتحضير لتر واحد وتذوب في الحجم المناسب من الماء.

الشكل 349. قمع لصب عينة في دورق.
بعد تحضير المحلول ، يجب فحصه بالمعايرة باستخدام محلول مناسب من مادة أخرى ذات حالة طبيعية معروفة. قد لا يتوافق الحل المُعد تمامًا مع الوضع الطبيعي المعطى. في مثل هذه الحالات ، يتم إدخال تعديل في بعض الأحيان.
في مختبرات الإنتاج ، يتم أحيانًا تحضير حلول دقيقة "حسب المادة المراد تحديدها". يسهل استخدام مثل هذه الحلول العمليات الحسابية في التحليلات ، حيث يكفي مضاعفة حجم المحلول المستخدم للمعايرة بمعيار المحلول من أجل الحصول على محتوى المادة المرغوبة (بالجرام) بكمية أي محلول مأخوذة للتحليل.
عند تحضير محلول معاير للتحليل ، يتم الحساب أيضًا وفقًا للمكافئ بالجرام للمادة المذابة ، باستخدام الصيغة:

مثال. يجب تحضير 3 لترات من محلول برمنجنات البوتاسيوم بعيار حديد 0.0050 جم / مل. المكافئ بالجرام لـ KMnO4 هو 31.61 والمكافئ بالجرام Fe هو 55.847.
نحسب وفقًا للصيغة أعلاه:

الحلول القياسية.تسمى المحاليل المعيارية محاليل ذات تركيزات مختلفة ومحددة بدقة مستخدمة في قياس الألوان ، على سبيل المثال ، المحاليل التي تحتوي على 0.1 ، 0.01 ، 0.001 مجم ، إلخ من مذاب في 1 مل.
بالإضافة إلى التحليل اللوني ، هناك حاجة إلى مثل هذه الحلول عند تحديد الرقم الهيدروجيني ، لتحديدات قياس nephelometric ، وما إلى ذلك. في بعض الأحيان يتم تخزين المحاليل القياسية في أمبولات محكمة الغلق ، ولكن في كثير من الأحيان يجب تحضيرها على الفور قبل الاستخدام. يتم تحضير المحاليل القياسية بحجم لا أكثر من 1 لتر ، وفي كثير من الأحيان - أقل. فقط مع الاستهلاك الكبير للحل القياسي ، من الممكن تحضير عدة لترات منه ، ثم بشرط عدم تخزين الحل القياسي لفترة طويلة.
يتم حساب كمية المادة (بالجرام) المطلوبة للحصول على مثل هذه الحلول بالصيغة:

مثال. من الضروري تحضير المحاليل القياسية لـ CuSO4 · 5H2O لتحديد القياس اللوني للنحاس ، ويجب أن يحتوي 1 مل من المحلول الأول على 1 مجم من النحاس ، والثاني - 0.1 مجم ، والثالث - 0.01 مجم ، والرابع - 0.001 مجم. قم أولاً بإعداد كمية كافية من المحلول الأول ، على سبيل المثال 100 مل.
غالبًا ما يتم استخدام بيكربونات الصوديوم في شكل محلول الصودا. أصبحت البشرية على دراية بالخصائص المفيدة للصودا منذ وقت ليس ببعيد ، ولكن محلول الصودا يستخدم بالفعل بنشاط في العديد من مجالات الحياة البشرية ، مرة أخرى يظهر تأثيره الإيجابي.
وصفات حلول الصودا التي تساعد في التغلب على الأمراض بسيطة للغاية ويمكن للجميع الوصول إليها.
كيف تستعد وأين تستخدم العلاج
يستخدم محلول الصودا على نطاق واسع في مختلف مجالات النشاط البشري. يستخدم بيكربونات الصوديوم الجافة نفسها في كل من الصناعة والطبخ ، ولكن محلول الصودا هو الأكثر طلبًا في البستنة والطب والتجميل.

من السهل جدًا تحضير المنتج - تتم إضافة الكمية المطلوبة من المسحوق الأبيض إلى السائل وخلطها حتى تذوب الجزيئات تمامًا. غالبًا ما يتم تقليب الصودا في الماء ، ولكن لعلاج بعض الأمراض ، يكون بيكربونات الصوديوم أكثر فائدة مع الحليب منه مع الماء. لكن في مستحضرات التجميل ، يتم عمل محلول الصودا على أساس الشامبو الذي يستخدم لغسل الشعر.
على الرغم من أنه من السهل عمل محلول الصودا ، فمن المهم عند تحضيره مراقبة نسب المواد الموصى بها بشكل صحيح.
خلاف ذلك ، لا يمكن أن تصبح الأداة عديمة الفائدة فحسب ، بل يمكن أن تكون ضارة أيضًا.

التطبيق في البستنة
بالنسبة للحديقة والحديقة النباتية ، لا غنى عن محلول صودا الخبز. باستخدامه يمكنك:
- تخلص من البياض الدقيقي - مرض يصيب العديد من النباتات المزروعة الذي يدمر أوراق الشجر الصغيرة ؛
- تجديد شجيرات الورد عن طريق إضافة القليل من الأمونيا إلى محلول البيكربونات ؛
- القضاء على الحشائش الصغيرة التي تشق طريقها في شقوق ممرات الحدائق ؛
- هزيمة اليرقات التي تأكل أوراق الملفوف الصغيرة ؛
- إطعام الطماطم ، وبعد ذلك ستصبح ثمارها أكثر لحومًا وحلاوة ؛
- تحمض التربة لزراعة أنواع معينة من النباتات المزروعة ؛
- حماية العنب من العفن الرمادي وجعل التوت أكثر سكرية ؛
- نظف يديك بعد العمل في الحديقة من الأوساخ الراسخة فيها.
التطبيق في الطب
محلول الصودا منقذ حقيقي للعديد من الأمراض. حتى أن بعض الأطباء يصرون على أن بيكربونات الصوديوم يمكن أن تعالج السرطان.
 الغرغرة بمحلول الصودا بسرعة كبيرة وبشكل ملحوظ يخفف الانزعاج في الحلق.
الغرغرة بمحلول الصودا بسرعة كبيرة وبشكل ملحوظ يخفف الانزعاج في الحلق. ومع ذلك ، بينما لا تزال الأبحاث حول تأثير الصودا على أمراض الأورام جارية ، فمن الآمن القول أن هذه المادة قادرة على التعامل مع العديد من الأمراض:
- حرقة - العلاج يحيد الحموضة العالية.
- نزلات البرد - بيكربونات الصوديوم قادرة على تخفيف الأعراض الأولى لنزلات البرد ومنع تطور المرض ؛
- طفح الحفاضات عند الرضع - المحلول يعزز الشفاء السريع للجروح على سطح الجلد ؛
- التهاب المثانة - تساعد الصودا في حالة مذابة الجسم على محاربة الكائنات الحية الدقيقة المسببة للأمراض ؛
- الحروق - محلول بيكربونات الصوديوم المطبق على المنطقة المصابة يخفف الألم ، وتلتئم الجروح بشكل أسرع ؛
- ارتفاع ضغط الدم - تساعد بيكربونات الصوديوم على إزالة الماء الزائد وتقليله بشكل كبير الضغط الشرياني;
- سيلان الأنف - يحل محلول بسيط من الصودا والملح محل المستحضرات الصيدلانية باهظة الثمن تمامًا ، ويمكنك شطف أنفك به بقدر ما تريد دون الإضرار بالصحة ؛
- القلاع - بمساعدة بيكربونات الصوديوم ، يمكنك التخلص من مرض القلاع الذي تكرهه النساء ، لأن فطر المبيضات يخاف من البيئة القلوية ؛
- السعال المطول - بمساعدة الصودا والعسل المذاب في الحليب ، يمكنك التخلص من السعال الجاف الطويل ، وتعزيز إفراز البلغم ؛
- التهاب الحلق - الغرغرة بمحلول الصودا يخفف من مظاهر المرض ، ويساهم في إفراز سدادات قيحية وتطهير الحلق ، وأيضًا عند خروج القيح ، تنخفض درجة حرارة الجسم بشكل كبير ويصبح الشخص أفضل بكثير ؛
- التهاب الجلد والصدفية - مستحضرات الصودا لها تأثير مفيد للغاية على سطح الجلد المصاب ؛
- الكالو ، الدمامل والذرة ، التي توضع على سطحها قطعة قطن مغموسة في المنتج المحضر ؛
- التدخين - بمساعدة محلول بيكربونات الصوديوم ، يشطف المدخنون أفواههم ؛
- الخبث والسموم التي تذوب الصودا في الماء تزيل بنجاح من الجسم ؛
- مظاهر دوار الحركة أثناء النقل.
التطبيق في التجميل
لإضفاء جمال وقوة على الأطراف المتقصفة ، يمكنك استخدام منتج يحتوي على البيكربونات ، المصنوع قبل إجراء غسل الشعر بالشامبو مباشرةً. لهذا ، 2 ملعقة صغيرة. يجب إضافة الصودا إلى 3 ملاعق كبيرة. ل. الشامبو للحصول على منتج مركز قوي إلى حد ما. يغسلون شعرهم بهذا الشامبو مرة في الأسبوع ، وفي أوقات أخرى يستخدمون المنظفات العادية. بعد شهر ، يمكنك ملاحظة أن الشعر يكتسب قوة ، ويقل تقصفه ، ويصبح كثيفًا ولامعًا.
أيضا ، يمكن خلط بيكربونات الصوديوم مع جل الجسم لعمل نوع من التقشير وتقشير الجزيئات الميتة من البشرة من الجسم. سيساعد ذلك في جعل بشرتك تبدو أكثر صحة.
بمساعدة بيكربونات الصوديوم ، يمكنك استعادة التوازن الحمضي للجلد ، وبالتالي القضاء على حب الشباب على سطحه. للقيام بذلك ، تُغمس قطعة قطن في الصودا وتُمسح على الوجه مرتين في الأسبوع. امسحي بشرة الوجه برفق شديد ، بحركات تدليك ، مع تجنب المنطقة تحت العينين. إذا قمت بهذا الإجراء بانتظام ، فلن يظهر حب الشباب على سطح الجلد لفترة طويلة.
لتطبيق الصودا بنجاح ، من المهم جدًا الانتباه إلى كيفية صنع الحل بشكل صحيح. يجب ألا تخلط النسب بالعين وتفترض أن مثل هذا العلاج سيصبح مساعدًا - في كثير من الحالات ، كانت زيادة جرعة المادة الرئيسية هي التي تسببت في الحساسية أو تفاقم حالة المريض. وفي البستنة ، فإن محلول رماد الصودا القوي جدًا قادر تمامًا على تدمير المحصول.
بالنسبة للسؤال ، أخبرني كيف أصنع محلولًا بنسبة 1 ٪ بكبريتات النحاس والجير (أو رماد الصودا) الذي قدمه المؤلف لاريسا ليمارأفضل إجابة هي أن سائل بوردو غير جاهز برماد الصودا. رماد الصودا هو كربونات الصوديوم ، وأنت بحاجة إلى هيدروكسيد الكالسيوم (الجير المطفأ). خلاف ذلك ، سوف تحصل على الملكيت. كيف تطبخ - اقرأ:
إجابة من مجتهد.[خبير]
إجابة من فاصل[خبير]
إجابة من I- شعاع[خبير]
إجابة من خاص[خبير]
لتحضير محلول نحاسي بنسبة 1٪ ، قم بتخفيف 100 غرام من الزجاج في 10 لترات من الماء ومعادلة 100 غرام من الجير المطفأ == >>
إجابة من ناتالي ناتالي[خبير]
إجابة من زانا س[خبير]
1-٪ خليط بورديو.
ويخفف أيضًا بـ 5 لترات من الماء.
(على الأوراق الخضراء).
1- سائل بورجوندي٪
أضف 50 جم. صابون.
COPPER_SOAP SOLUTION.
+ صابون بنفس المقدار.
النجاح في مكافحة الأمراض)
إجابة من مجتهد.[خبير]
شراء أفضل سائل بوردو الجاهز.
إجابة من غالينا روسوفا (تشوركينا) جالج[خبير]
معالجة النباتات من PHYTOFTORA من أمراض أخرى
إجابة من إيلينا أكينتيفا[خبير]
لا تعاني من خليط بوردو ، وهو إعداد غير مريح للغاية من حيث التحضير (لا يمتزج جيدًا) والمعالجة (يسد البخاخ). اشتري Ordan أو Abiga-Peak ، مبيدات فطريات رائعة ، بدون متاعب.
إجابة من كوستينكو سيرجي[خبير]
لتحضير محلول نحاسي بنسبة 1٪ ، قم بتخفيف 100 غرام من الزجاج في 10 لترات من الماء ومعادلة 100 غرام من الجير المطفأ == >> 10 لترات من بوردو بتركيز نحاسي بنسبة 1٪
إجابة من ناتالي ناتالي[خبير]
خفف 100 جرام من كبريتات النحاس في 5 لترات من الماء الدافئ وخفف 100 جرام من الجير بشكل منفصل في 5 لترات من الماء. ثم صب محلول الزاج في محلول الجير - وليس العكس واحصل على محلول 1٪ من خليط بوردو. بمعنى آخر: 10 لترات من الماء - 100 غرام من اللاير والزاج
إجابة من زانا س[خبير]
يتم تحضير خليط بوردو على أساس كبريتات النحاس والجير.
بورجوندي - من كبريتات النحاس والصودا (يمكن أيضًا استخدام الطعام) + الصابون.
1-٪ خليط بورديو.
100 غرام من الجير الحي وتروي في كمية صغيرة من الماء ، مخففة بالماء حتى 5 لترات ، يتم الحصول على حليب الجير.
في حاوية أخرى (غير معدنية)
قم بإذابة 100 جرام من كبريتات النحاس في الماء الساخن
ويخفف أيضًا بـ 5 لترات من الماء.
يُسكب محلول من كبريتات النحاس في حليب الجير ويخلط جيدًا.
النحاس إلى الجير ، وليس العكس!
يمكنك إذابة 100 جرام من كبريتات النحاس في 1 لتر من الماء الساخن
ثم اسكبي ، مع التحريك التدريجي ، في 9 لترات من حليب الليمون.
لكن خلط كلا المحلين المركزين ،
ثم يتم تخفيفه بالماء حتى 10 لترات غير مقبول.
اتضح مزيج من نوعية رديئة.
السائل المحضر بشكل صحيح له لون فيروزي وأزرق سماوي وتفاعل محايد أو قلوي قليلاً.
يتم اختبار الحموضة بورق عباد الشمس.
وهو مصبوغ باللون الأزرق.
يمكنك إنزال أي قطعة حديد نظيفة (غير صدئة) في المحلول.
في بيئة حمضية ، يستقر النحاس بنشاط على الحديد.
سيؤدي المزيج الحمضي إلى حرق الأوراق.
يتم تحييده بإضافة حليب الجير.
يتم تطبيق خليط 1٪ على النباتات النباتية
(على الأوراق الخضراء).
1- سائل بورجوندي٪
100 جرام من كبريتات النحاس و 100 جرام من رماد الصودا لكل 10 لترات من الماء. تذوب بشكل منفصل.
تندمج معًا ، تحقق من الحموضة ،
على سبيل المثال ، يتم تحضيرها بنفس طريقة تحضير خليط بوردو ، يتم استبدال الجير فقط بالصودا.
أضف 50 جم. صابون.
COPPER_SOAP SOLUTION.
يتم إذابة 10 جم من كبريتات النحاس في 0.5 لتر من الماء الساخن.
بشكل منفصل ، يتم تخفيف 100 جرام من الصابون في 10 لترات من الماء (يفضل أن تكون دافئة).
يُسكب محلول من كبريتات النحاس في محلول صابون في تيار رفيع مع التحريك المستمر.
يتم تحضير الدواء قبل الرش.
يمكن تحضير مستحلب النحاس والصابون بتركيزات أعلى
(20 جرام كبريتات النحاس و 200 جرام صابون
أو 30 جم من الزجاج و 300 جرام من الصابون لكل 10 لترات من الماء).
يجب أن يكون للمستحلب المحضر بشكل صحيح لون مخضر وليس قشور.
لتجنب تجلط الدواء في حالات تحضيره في الماء العسر ،
تقليل كمية كبريتات النحاس
أو أضف 0.5٪ (50 جم لكل 10 لتر من الماء) رماد الصودا (الكتان) إلى الماء.
يمكن استخدامه مع الكربوفوس (20 جم لكل 10 لتر من المستحلب)
للتحكم المتزامن في حشرات المن وعث العنكبوت.
رماد الصودا أو الغسيل ، الصودا (كربونات الصوديوم) عبارة عن مسحوق بلوري أبيض قابل للذوبان في الماء.
تستخدم للسيطرة على البياض الدقيقي
بتركيز 0.5٪ (50 جم لكل 10 لترات من الماء).
+ صابون بنفس المقدار.
لتحضير محلول عملي ، قم بتخفيف الصابون في الماء الطري وأضف الصودا ، سبق إذابته في كمية صغيرة من الماء.
النجاح في مكافحة الأمراض)
عند تحضير محاليل تركيز النسبة المئوية ، يتم وزن المادة على ميزان تقني-كيميائي ، ويتم قياس السوائل باستخدام أسطوانة قياس. لذلك ، عقبة! يتم حساب المواد بدقة 0.1 جم ، وحجم سائل واحد بدقة 1 مل.
قبل الشروع في تحضير المحلول | | من الضروري إجراء عملية حسابية ، أي حساب كمية المذاب والمذيب لإعداد كمية معينة من محلول تركيز معين.
حسابات في تحضير حلول الأملاح
مثال 1. من الضروري تحضير 500 جم من محلول 5٪ من نترات البوتاسيوم. يحتوي 100 جم من هذا المحلول على 5 جم من KN0 3 ؛ 1 نصنع النسبة:
100 جم محلول - 5 جم KN03
500 »1 - X»KN0 3
5-500 "_ x \ u003d -jQg- \ u003d 25 جم.
يجب تناول الماء 500-25 = 475 مل.
مثال 2. من الضروري تحضير 500 جم من محلول CaCl 5٪ من ملح CaCl 2 -6H 2 0. أولاً ، نحسب الملح اللامائي.
100 غ من المحلول - 5 غ من CaCl 2500 "" - X "CaCl 2 5-500 _ x = 100 = 25 جم -
الكتلة المولية لـ CaCl 2 \ u003d 111 ، الكتلة المولية لـ CaCl 2 - 6H 2 0 \ u003d 219 *. لذلك ، يحتوي 219 جم من CaCl 2 -6H 2 0 على 111 جم من CaCl 2. نصنع نسبة:
219 جم CaC1 2 -6H 2 0-111 جم CaC1 2
X "CaCl 2 -6H 2 0-26" CaCI ،
219-25 × \ u003d -jj- \ u003d 49.3 جم.
كمية الماء 500-49.3 = 450.7 جم أو 450.7 مل. نظرًا لأنه يتم قياس الماء باستخدام أسطوانة مدرجة ، فلا يتم أخذ أعشار المليلتر في الاعتبار. لذلك ، تحتاج إلى قياس 451 مل من الماء.
الحسابات في تحضير المحاليل الحمضية
عند تحضير المحاليل الحمضية ، يجب مراعاة أن المحاليل الحمضية المركزة ليست 100٪ وتحتوي على الماء. بالإضافة إلى ذلك ، لا يتم وزن الكمية المطلوبة من الحمض ، ولكن يتم قياسها باستخدام أسطوانة مدرجة.
مثال 1. من الضروري تحضير 500 جم من محلول حمض الهيدروكلوريك بنسبة 10٪ ، بناءً على حمض 58٪ المتاح ، وكثافته d = l ، 19.
1. أوجد كمية كلوريد الهيدروجين النقي التي يجب أن تكون في المحلول الحمضي المحضر:
100 جم محلول -10 جم HC1500 »» - X »HC1500-10 * = 100 = 50 جم -
* لحساب حلول النسبة المئوية لتركيز الشامة ، يتم تقريب الكتلة إلى أعداد صحيحة.
2. أوجد عدد جرامات المركزة)
الذي سيحتوي على 50 جم من HC1:
100 جم حمض - 38 جم هيدروكلوريد 1 X »» -50 »HC1100 50
X gg - "= 131.6 جرام.
3. ابحث عن الحجم الذي يشغله هذا المبلغ 1
الأحماض:
الخامس--— 131 ‘ 6 110 6 sch
4. كمية المذيب (الماء) 500-.
131.6 = 368.4 جم أو 368.4 مل. منذ التعاون الضروري-
يتم قياس كمية الماء والحمض بواسطة اسطوانة قياس
الروم ، ثم أعشار المليلتر لا تؤخذ في الاعتبار
أوت. لذلك ، لتحضير 500 جم من محلول 10٪
حمض الهيدروكلوريك ، يجب أن تأخذ 111 مل من حمض الهيدروكلوريك
أحماض و 368 مل من الماء.
مثال 2عادة ، في حسابات تحضير الأحماض ، يتم استخدام جداول قياسية ، والتي تشير إلى النسبة المئوية للمحلول الحمضي ، وكثافة محلول معين عند درجة حرارة معينة ، وعدد جرامات هذا الحمض الموجودة في لتر واحد من المحلول لتركيز معين (انظر الملحق الخامس). في هذه الحالة ، يتم تبسيط الحساب. يمكن حساب كمية المحلول الحمضي المحضر لحجم معين.
على سبيل المثال ، تحتاج إلى تحضير 500 مل من محلول حمض الهيدروكلوريك بنسبة 10٪ ، بناءً على محلول مركّز بنسبة 38٪. وفقًا للجداول ، نجد أن محلول حمض الهيدروكلوريك 10٪ يحتوي على 104.7 جم من HC1 في 1 لتر من المحلول. نحتاج إلى تحضير 500 مل من I ، لذلك ، يجب أن يكون المحلول 104.7: 2 \ u003d 52.35 جم من H O.
احسب المقدار الذي تحتاجه لأخذ المركز أناالأحماض. وفقًا للجدول ، يحتوي 1 لتر من HC1 المركز على 451.6 جم من HC1. نصنع النسبة: 1000 مل - 451.6 جم من HC1 X »-52.35» HC1
1000-52.35 × \ u003d 451.6 \ u003d "5 مل.
كمية الماء 500-115 = 385 مل.
لذلك ، لتحضير 500 مل من محلول حمض الهيدروكلوريك 10٪ ، يجب أن تأخذ 115 مل من محلول HC1 المركز و 385 مل من الماء.